Desde el comienzo de los tiempos, los seres humanos han tratado de comprender de qué está compuesto el universo y todo lo que contiene. Y mientras los antiguos magos y filósofos concibieron un mundo compuesto por cuatro o cinco elementos (tierra, aire, agua, fuego (y metal o conciencia)) por la antigüedad clásica, los filósofos comenzaron a teorizar que toda la materia estaba compuesta de diminutos, átomos invisibles e indivisibles.
Desde entonces, los científicos se han involucrado en un proceso de descubrimiento continuo con el átomo, con la esperanza de descubrir su verdadera naturaleza y composición. En el siglo XX, nuestra comprensión se perfeccionó hasta el punto de que pudimos construir un modelo preciso de la misma. Y en la última década, nuestra comprensión ha avanzado aún más, hasta el punto de que hemos llegado a confirmar la existencia de casi todas sus partes teorizadas.
Hoy, la investigación atómica se centra en estudiar la estructura y la función de la materia a nivel subatómico. Esto no solo consiste en identificar todas las partículas subatómicas que se cree que forman un átomo, sino también en investigar las fuerzas que las gobiernan. Estos incluyen fuerzas nucleares fuertes, fuerzas nucleares débiles, electromagnetismo y gravedad. Aquí hay un desglose de todo lo que hemos aprendido sobre el átomo hasta ahora ...
Estructura del átomo:
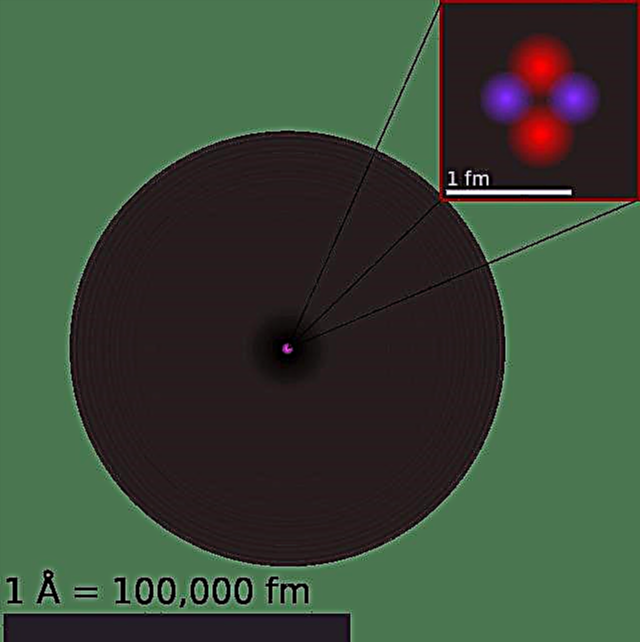
Nuestro modelo actual del átomo se puede dividir en tres partes constituyentes: protones, neutrones y electrones. Cada una de estas partes tiene una carga asociada, con protones con carga positiva, electrones con carga negativa y neutrones sin carga neta. De acuerdo con el Modelo Estándar de física de partículas, los protones y los neutrones forman el núcleo del átomo, mientras que los electrones lo orbitan en una "nube".

Los electrones en un átomo son atraídos a los protones en el núcleo por la fuerza electromagnética. Los electrones pueden escapar de su órbita, pero solo en respuesta a una fuente externa de energía que se aplica. La órbita más cercana del electrón al núcleo, mayor es la fuerza de atracción; por lo tanto, cuanto más fuerte sea la fuerza externa necesaria para hacer que un electrón escape.
Los electrones orbitan el núcleo en múltiples órbitas, cada una de las cuales corresponde a un nivel de energía particular del electrón. El electrón puede cambiar su estado a un nivel de energía más alto al absorber un fotón con energía suficiente para impulsarlo al nuevo estado cuántico. Del mismo modo, un electrón en un estado de mayor energía puede caer a un estado de menor energía mientras irradia el exceso de energía como un fotón.
Los átomos son eléctricamente neutros si tienen el mismo número de protones y electrones. Los átomos que tienen un déficit o un exceso de electrones se llaman iones. Los electrones que están más alejados del núcleo pueden transferirse a otros átomos cercanos o compartirse entre átomos. Mediante este mecanismo, los átomos pueden unirse a moléculas y otros tipos de compuestos químicos.
Las tres partículas subatómicas son fermiones, una clase de partículas asociadas con la materia que es de naturaleza elemental (electrones) o compuesta (protones y neutrones). Esto significa que los electrones no tienen una estructura interna conocida, mientras que los protones y los neutrones están formados por otras partículas subatómicas. llamados quarks. Hay dos tipos de quarks en los átomos, que tienen una carga eléctrica fraccional.

Los protones están compuestos por dos quarks "arriba" (cada uno con una carga de +2/3) y un quark "abajo" (-1/3), mientras que los neutrones consisten en un quark arriba y dos quarks abajo. Esta distinción explica la diferencia de carga entre las dos partículas, que se traduce en una carga de +1 y 0 respectivamente, mientras que los electrones tienen una carga de -1.
Otras partículas subatómicas incluyen los leptones, que se combinan con los fermiones para formar los bloques de construcción de la materia. Hay seis leptones en el presente modelo atómico: las partículas de electrones, muones y tau, y sus neutrinos asociados. Las diferentes variedades de partículas de Lepton, comúnmente llamadas "sabores", se diferencian por sus tamaños y cargas, lo que afecta el nivel de sus interacciones electromagnéticas.
Luego, están los Gauge Bosons, que se conocen como "portadores de fuerza", ya que median las fuerzas físicas. Por ejemplo, los gluones son responsables de la fuerte fuerza nuclear que mantiene unidos a los quarks, mientras que se cree que los bosones W y Z (aún hipotéticos) son responsables de la débil fuerza nuclear detrás del electromagnetismo. Los fotones son la partícula elemental que forma la luz, mientras que el bosón de Higgs es responsable de darles masa a los bosones W y Z.
Masa atomica:
La mayoría de la masa de un átomo proviene de los protones y neutrones que forman su núcleo. Los electrones son las partículas constituyentes menos masivas de un átomo, con una masa de 9.11 x 10-31 kg y un tamaño demasiado pequeño para ser medido por las técnicas actuales. Los protones tienen una masa que es 1,836 veces la del electrón, a 1.6726 × 10-27 kg, mientras que los neutrones son los más masivos de los tres, con 1.6929 × 10-27 kg (1,839 veces la masa del electrón).

El número total de protones y neutrones en el núcleo de un átomo (llamados "nucleones") se denomina número de masa. Por ejemplo, el elemento Carbono-12 se llama así porque tiene un número de masa de 12, derivado de sus 12 nucleones (seis protones y seis neutrones). Sin embargo, los elementos también se organizan en función de sus números atómicos, que es el mismo que el número de protones que se encuentran en el núcleo. En este caso, el carbono tiene un número atómico de 6.
La masa real de un átomo en reposo es muy difícil de medir, ya que incluso el más masivo de los átomos es demasiado ligero para expresarse en unidades convencionales. Como tal, los científicos a menudo usan la unidad de masa atómica unificada (u), también llamada dalton (Da), que se define como una doceava parte de la masa de un átomo neutro libre de carbono-12, que es aproximadamente 1.66 × 10-27 kg.
Los químicos también usan moles, una unidad definida como un mol de cualquier elemento que siempre tiene el mismo número de átomos (aproximadamente 6.022 × 1023) Se eligió este número de modo que si un elemento tiene una masa atómica de 1 u, un mol de átomos de ese elemento tiene una masa cercana a un gramo. Debido a la definición de la unidad de masa atómica unificada, cada átomo de carbono 12 tiene una masa atómica de exactamente 12 u, por lo que un mol de átomos de carbono 12 pesa exactamente 0.012 kg.
Desintegración radioactiva:
Cualquiera de los dos átomos que tienen el mismo número de protones pertenecen al mismo elemento químico. Pero los átomos con un número igual de protones pueden tener un número diferente de neutrones, que se definen como isótopos diferentes del mismo elemento. Estos isótopos son a menudo inestables, y se sabe que todos aquellos con un número atómico mayor que 82 son radiactivos.
Cuando un elemento sufre descomposición, su núcleo pierde energía al emitir radiación, que puede consistir en partículas alfa (átomos de helio), partículas beta (positrones), rayos gamma (energía electromagnética de alta frecuencia) y electrones de conversión. La velocidad a la que se desintegra un elemento inestable se conoce como su "vida media", que es la cantidad de tiempo requerida para que el elemento caiga a la mitad de su valor inicial.
La estabilidad de un isótopo se ve afectada por la relación de protones a neutrones. De los 339 tipos diferentes de elementos que ocurren naturalmente en la Tierra, 254 (alrededor del 75%) han sido etiquetados como "isótopos estables", es decir, no están sujetos a la descomposición. Otros 34 elementos radiactivos tienen vidas medias de más de 80 millones de años, y también han existido desde el Sistema Solar temprano (de ahí por qué se llaman "elementos primordiales").
Finalmente, se sabe que 51 elementos adicionales de vida corta ocurren naturalmente, como "elementos hijos" (es decir, subproductos nucleares) de la descomposición de otros elementos (como el radio del uranio). Además, los elementos radiactivos de corta duración pueden ser el resultado de procesos energéticos naturales en la Tierra, como el bombardeo de rayos cósmicos (por ejemplo, el carbono 14, que ocurre en nuestra atmósfera).
Historia de estudio:
Los primeros ejemplos conocidos de teoría atómica provienen de la antigua Grecia y la India, donde filósofos como Demócrito postularon que toda la materia estaba compuesta de unidades diminutas, indivisibles e indestructibles. El término "átomo" fue acuñado en la antigua Grecia y dio origen a la escuela de pensamiento conocida como "atomismo". Sin embargo, esta teoría era más un concepto filosófico que científico.
No fue sino hasta el siglo XIX que la teoría de los átomos se articuló como una cuestión científica, con los primeros experimentos basados en evidencia que se llevaron a cabo. Por ejemplo, a principios de 1800, el científico inglés John Dalton utilizó el concepto del átomo para explicar por qué los elementos químicos reaccionaron de ciertas maneras observables y predecibles.
Dalton comenzó con la pregunta de por qué los elementos reaccionaron en proporciones de números enteros pequeños, y concluyó que estas reacciones ocurrieron en múltiplos enteros de unidades discretas, en otras palabras, átomos. A través de una serie de experimentos con gases, Dalton desarrolló lo que se conoce como la teoría atómica de Dalton, que sigue siendo una de las piedras angulares de la física y la química modernas.
La teoría se reduce a cinco premisas: los elementos, en su estado más puro, consisten en partículas llamadas átomos; los átomos de un elemento específico son todos iguales, hasta el último átomo; los átomos de diferentes elementos pueden distinguirse por sus pesos atómicos; átomos de elementos se unen para formar compuestos químicos; los átomos no se pueden crear ni destruir en una reacción química, solo cambia la agrupación.
A fines del siglo XIX, los científicos comenzaron a teorizar que el átomo estaba formado por más de una unidad fundamental. Sin embargo, la mayoría de los científicos se aventuraron a que esta unidad sería del tamaño del átomo más pequeño conocido: el hidrógeno. Y luego, en 1897, a través de una serie de experimentos con rayos catódicos, el físico J.J. Thompson anunció que había descubierto una unidad que era 1000 veces más pequeña y 1800 veces más ligera que un átomo de hidrógeno.

Sus experimentos también mostraron que eran idénticos a las partículas emitidas por el efecto fotoeléctrico y por los materiales radiactivos. Experimentos posteriores revelaron que esta partícula transportaba corriente eléctrica a través de cables metálicos y cargas eléctricas negativas dentro de los átomos. Por eso la partícula, que originalmente se llamaba "corpúsculo", se cambió más tarde a "electrón", después de la partícula predicha por George Johnstone Stoney en 1874.
Sin embargo, Thomson también postuló que los electrones se distribuían por todo el átomo, que era un mar uniforme de carga positiva. Esto se conoció como el "modelo de pudín de ciruela", que luego se demostraría que estaba equivocado. Esto tuvo lugar en 1909, cuando los físicos Hans Gieger y Ernest Marsden (bajo la dirección de Ernest Rutherfod) llevaron a cabo su experimento utilizando láminas de metal y partículas alfa.
De acuerdo con el modelo atómico de Dalton, creían que las partículas alfa pasarían directamente a través de la lámina con poca desviación. Sin embargo, muchas de las partículas se desviaron en ángulos superiores a 90 °. Para explicar esto, Rutherford propuso que la carga positiva del átomo se concentra en un pequeño núcleo en el centro.
En 1913, el físico Niels Bohr propuso un modelo donde los electrones orbitaban el núcleo, pero solo podían hacerlo en un conjunto finito de órbitas. También propuso que los electrones pudieran saltar entre órbitas, pero solo en cambios discretos de energía correspondientes a la absorción o radiación de un fotón. Esto no solo refinó el modelo propuesto por Rutherford, sino que también dio lugar al concepto de un átomo cuantificado, donde la materia se comportaba en paquetes discretos.

El desarrollo del espectrómetro de masas, que utiliza un imán para doblar la trayectoria de un haz de iones, permitió medir la masa de los átomos con mayor precisión. El químico Francis William Aston usó este instrumento para mostrar que los isótopos tenían diferentes masas. Esto a su vez fue seguido por el físico James Chadwick, quien en 1932 propuso el neutrón como una forma de explicar la existencia de isótopos.
A principios del siglo XX, la naturaleza cuántica de los átomos se desarrolló aún más. En 1922, los físicos alemanes Otto Stern y Walther Gerlach realizaron un experimento en el que un haz de átomos de plata se dirigía a través de un campo magnético, que tenía la intención de dividir el haz entre la dirección del momento angular (o giro) de los átomos.
Conocido como el Experimento Stern-Gerlach, el resultado fue que el haz se dividió en dos partes, dependiendo de si el giro de los átomos estaba orientado hacia arriba o hacia abajo. En 1926, el físico Erwin Schrodinger utilizó la idea de que las partículas se comportaran como ondas para desarrollar un modelo matemático que describiera los electrones como formas de onda tridimensionales en lugar de simples partículas.
Una consecuencia del uso de formas de onda para describir partículas es que es matemáticamente imposible obtener valores precisos para la posición y el momento de una partícula en un momento dado. Ese mismo año, Werner Heisenberg formuló este problema y lo llamó el "principio de incertidumbre". Según Heisenberg, para una medición precisa dada de la posición, solo se puede obtener un rango de valores probables para el momento, y viceversa.

En la década de 1930, los físicos descubrieron la fisión nuclear, gracias a los experimentos de Otto Hahn, Lise Meitner y Otto Frisch. Los experimentos de Hahn implicaron dirigir los neutrones a los átomos de uranio con la esperanza de crear un elemento de transuranio. En cambio, el proceso convirtió su muestra de uranio-92 (Ur92) en dos elementos nuevos: bario (B56) y criptón (Kr27).
Meitner y Frisch verificaron el experimento y lo atribuyeron a la división de los átomos de uranio para formar dos elementos con el mismo peso atómico total, un proceso que también liberaba una cantidad considerable de energía al romper los enlaces atómicos. En los años que siguieron, comenzó la investigación sobre la posible fabricación de armas de este proceso (es decir, armas nucleares) y condujo a la construcción de las primeras bombas atómicas en los EE. UU. En 1945.
En la década de 1950, el desarrollo de aceleradores de partículas y detectores de partículas mejorados permitió a los científicos estudiar los impactos de los átomos que se mueven a altas energías. A partir de esto, se desarrolló el Modelo Estándar de física de partículas, que hasta ahora ha explicado con éxito las propiedades del núcleo, la existencia de partículas subatómicas teorizadas y las fuerzas que gobiernan sus interacciones.
Experimentos modernos
Desde la segunda mitad del siglo XX, se han realizado muchos descubrimientos nuevos y emocionantes con respecto a la teoría atómica y la mecánica cuántica. Por ejemplo, en 2012, la larga búsqueda del Bosón de Higgs condujo a un gran avance donde los investigadores que trabajan en la Organización Europea para la Investigación Nuclear (CERN) en Suiza anunciaron su descubrimiento.

En las últimas décadas, los físicos han dedicado una gran cantidad de tiempo y energía al desarrollo de una teoría de campo unificado (también conocido como Gran teoría unificadora o teoría de todo). En esencia, desde que se propuso por primera vez el Modelo Estándar, los científicos han tratado de comprender cómo las cuatro fuerzas fundamentales del universo (gravedad, fuerzas nucleares fuertes y débiles y electromagnetismo) trabajan juntas.
Mientras que la gravedad puede entenderse usando las teorías de la relatividad de Einstein, y las fuerzas nucleares y el electromagnetismo pueden entenderse usando la teoría cuántica, ninguna teoría puede explicar las cuatro fuerzas que trabajan juntas. Los intentos de resolver esto han llevado a una serie de teorías propuestas a lo largo de los años, que van desde la teoría de cuerdas hasta la gravedad cuántica de bucles. Hasta la fecha, ninguna de estas teorías ha llevado a un gran avance.
Nuestra comprensión del átomo ha recorrido un largo camino, desde los modelos clásicos que lo vieron como un sólido inerte que interactúa mecánicamente con otros átomos, hasta las teorías modernas donde los átomos están compuestos de partículas energéticas que se comportan de manera impredecible. Si bien ha tomado varios miles de años, nuestro conocimiento de la estructura fundamental de toda la materia ha avanzado considerablemente.
Y, sin embargo, quedan muchos misterios que aún no se han resuelto. Con el tiempo y los esfuerzos continuos, finalmente podemos desbloquear los últimos secretos restantes del átomo. Por otra parte, podría muy bien ser que cualquier descubrimiento nuevo que hagamos solo genere más preguntas, ¡y podrían ser aún más confusas que las anteriores!
Hemos escrito muchos artículos sobre el átomo para la revista Space. Aquí hay un artículo sobre el modelo atómico de John Dalton, el modelo atómico de Neils Bohr, ¿Quién fue Demócrito ?, y ¿Cuántos átomos hay en el universo?
Si desea obtener más información sobre el átomo, consulte el artículo de la NASA sobre el análisis de pequeñas muestras, y aquí hay un enlace al artículo de la NASA sobre átomos, elementos e isótopos.
También hemos grabado un episodio completo de Astronomy Cast sobre el átomo. Escuche aquí, Episodio 164: Dentro del átomo, Episodio 263: Decaimiento radiactivo, y Episodio 394: El modelo estándar, Bosones.